HPV NA MULHER : ENTENDA COMO OCORRE E SEUS ATUAIS TRATAMENTOS
- 2014/outubro/13
- Comentar
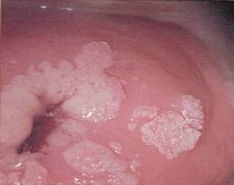
À medida que os conhecimentos sobre o papilomavírus humano (HPV) avançam, abrem-se novas portas para entender e tratar mais adequadamente as lesões induzidas por este vírus. Sabe-se que a maioria das pessoas sexualmente ativas (mais de 75%) entra em contato com o HPV, mas que apenas uma minoria apresenta alguma repercussão clínica. Estudos atuais revelam que existe eliminação espontânea do vírus, através da ativação do sistema imune, em mais de 90% dos indivíduos infectados no período de 24 meses. Ambas as infecções por HPV de baixo e alto risco podem regredir espontaneamente sugerindo que o sistema imune responde aos dois grupos de vírus. O tipo de resposta imune do hospedeiro determina o curso da doença (persistência ou regressão), a extensão e severidade das lesões e o sucesso da terapia.
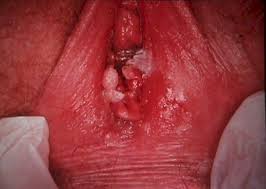
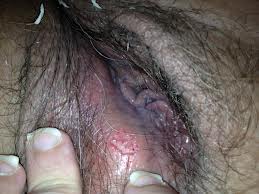
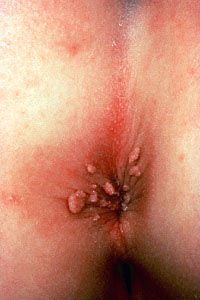
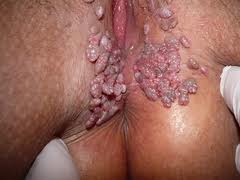
Até recentemente, o objetivo do tratamento da infecção clínica pelo HPV era a remoção da doença clínica e visível através da destruição dos condilomas com métodos destrutivos e/ou excisionais, não atuando diretamente na causa do problema, o HPV. Por este motivo, recorrências são freqüentes (30% a 50%) por meses ou anos devido à replicação viral que ocorre no tecido periférico à lesão tratada. Como o HPV é doença que se limita apenas à camada epitelial, não ultrapassando a membrana basal, a exposição imunológica primária deve ocorrer através dos mecanismos existentes nesta camada. Como a célula epitelial não é boa apresentadora de antígenos, o HPV permanece dentro dela sem ser reconhecido pelo sistema imune. Devido ao fato do HPV não causar lise ou morte da célula do hospedeiro, o vírus permanece isolado do contato de células do sistema imune (monócitos, células dendríticas e macrófagos) que iniciam o processo de reconhecimento imune. O atraso no reconhecimento da presença do HPV é o responsável pela natureza recalcitrante da maioria das lesões induzidas pelo HPV31.
Os eventos necessários para a indução da resposta imune ocorrem da mesma maneira em lesões induzidas por HPV de baixo e alto risco, e em lesões externas e internas (vagina, cérvice e ânus). Este processo ocorrerá espontaneamente em 20% a 34% dos indivíduos infectados, marcando o final de lesões clínicas aparentes. Em outros 60%, a destruição localizada e repetida dos condilomas por período de até um ano estimulará este processo levando a remissão clínica mantida. Entretanto, em aproximadamente 20% das lesões HPV-induzidas não existe resposta às terapias citodestrutivas, sendo as mesmas refratárias a tratamentos padrões12.
IMUNIDADE
A defesa contra organismos estranhos, como vírus e bactérias, é mediada pela imunidade inata e pela imunidade específica ou adaptativa.
A primeira resposta do organismo é a resposta inata não-específica, ou seja, aquela apresentada pelo indivíduo sob condições naturais, sendo independente do contato com o agente infeccioso. Quando um agente estranho penetra no organismo, ele é rapidamente identificado e eliminado sem o organismo nunca ter entrado em contato antes com o mesmo. No caso de infecções virais, o organismo possui uma substância chamada interferon que interfere com a progressão ou proliferação da infecção viral. A imunidade inata tem a função de proteger o organismo temporariamente até o desenvolvimento da imunidade adquirida ou adaptativa, que é mais específica e efetiva2.
A imunidade adquirida é composta pela imunidade humoral e celular, sendo que cada uma acarreta um tipo característico de resposta (ver Tabela 8.1). Basicamente, este tipo de imunidade é constituído por linfócitos, que possuem a propriedade de reconhecer e distinguir diferentes determinantes antigênicos. Existem três classes de linfócitos: B, T e “natural killer cells”. Diferente dos linfócitos B que produzem anticorpos, os linfócitos T não produzem, mas reconhecem e respondem a antígenos associados à superfície das células. Os linfócitos T são subdivididos em linfócitos T helper ou auxiliares (a maioria das quais expressa uma proteína de membrana denominada CD4) e linfócitos T citotóxicos (cuja proteína de membrana e denominada CD8). Os linfócitos T citotóxicos lisam células que produzem antígenos estranhos, como as infectadas por vírus e outros microorganismos intracelulares.
A terceira classe de linfócitos e representada pelas células T “natural killer”, que não possuem marcadores de membrana e são capazes de lisar células tumorais e células infectadas por vírus sem evidente estimulação antigênica24. As fases efetoras de ambas as imunidades (inata e específica) são em parte mediadas por hormônios protéicos chamados citocinas. Na imunidade inata, as citocinas efetoras são em grande parte produzidas por fagócitos mononucleares e provocam reações inflamatórias ricas em neutrófilos que tentam conter e/ou erradicar infecções microbianas. A maioria das citocinas da imunidade específica é produzida por linfócitos T ativados.
As células T produzem várias citocinas que servem primariamente para regular o crescimento e diferenciação de várias populações de linfócitos, e assim tem importantes papéis na fase de ativação da célula T-respostas imunodependentes. Outra função primordial das citocinas derivadas de células T é ativar e regular células inflamatórias, como fagócitos mononucleares, neutrófilos e eosinófilos. Estas citocinas derivadas de células T agem na fase efetora da imunidade mediada por células e são responsáveis pela comunicação entre as células do sistema imune e inflamatório.
De acordo com o tipo de atuação dos linfócitos helper, a resposta imunológica adquirida encontra-se dividida em dois principais braços, denominados de TH-1 e TH-2, onde predominam respectivamente a resposta celular ou a humoral24. A ativação das células TH-1 resulta em produção da citocina interferon-gama; esta ativa a fagocitose pelos macrófagos que passam também a produzir outra citocina, a IL-1. A IL-1, por sua vez, estimula as células TH-1 a produzirem IL-2, o qual estimula a replicação das células TH-1 cuja função é reconhecer os microrganismos infectantes, os antígenos específicos para as células T citotóxicas e os antígenos não específicos para as células “natural killer”. Conseqüentemente, a defesa contra a infecção ocorre através da ação combinada da fagocitose e citotoxicidade. A citocina interferon-gama também inibe a ativação das células TH-2. Contrariamente, a ativação das células TH-2 resulta na liberação de diferentes citocinas (IL-4, IL-5, IL-10). A IL-10 inibem em especial a ativação das células TH-1 e as três citocinas estimulam a produção de anticorpos pelos linfócitos B. Neste caso, a defesa contra a infecção se faz pelos anticorpos e não por células (Tabela 8.1).
A evidência acumulada indica que imiquimode e seus análogos modulam a resposta imune inata através da ativação das células dendríticas, macrófagos e outras células, via ligação com receptor Toll 7 (TLR_7) para induzir a síntese de IFN-a e citocinas pró-inflamatórias Th1(veja a Tabela 8.2).
A indução de citocinas é evidente dentro de duas horas após o tratamento e concentrações máximas são mensuradas aproximadamente oito horas após aplicação da droga. A primeira citocina detectada é o IFN-a, concentrações máximas foram alcançadas após oito horas e permanecem constantes até 24 horas. Concentrações de TNF, Il-1 e IL-6 também alcançam pico em oito horas, mas concentrações máximas são significativamente mais baixas do que aquelas alcançadas pelo IFN e IL-8.
IMIQUIMODE
Agentes imunomoduladores, como o imiquimode e o interferon, podem auxiliar no estímulo da resposta imune. O tratamento com imiquimode reduz a carga viral em mais de 90% e auxilia no desenvolvimento de memória imunológica, o que poderia auxiliar no combate a recidivas2.
O imiquimode, um modificador da resposta biológica, mimetiza o que ocorre na resposta imune normal quando o HPV é reconhecido pelo sistema imune. Este derivado imidazoquinolínico estimula vários braços da imunidade inata e adaptativa em resposta ao reconhecimento de antígenos do HPV, induzindo a secreção de citocinas pelos macrófagos e monócitos (interferon-alfa, interleucina tipo 1, 6 e 12 e fator de necrose tumoral), resultando em resposta dominante helper tipo 1. O interferon limita a reprodução de partículas virais de HPV e tem atividade antiproliferativa que diminui o crescimento de células infectadas pelo HPV. As citocinas promovem o acúmulo de monócitos, macrófagos e células dendríticas, e estas últimas quando ativadas promovem a apresentação do antígeno para a produção de células T citotóxicas HPV-específicas (CD8). As células T HPV-específicas e células “natural killer” matam as células infectadas pelo HPV. Os monócitos e macrófagos fagocitam o debris celular. Os efeitos combinados destas ações resultam em redução do tamanho da lesão e desaparecimento da mesma. A indução destas citocinas ocorre rapidamente após a aplicação do creme de imiquimode (6 a 8 horas), e acredita-se que altos níveis possam ser mantidos até por 16 semanas após aplicação do creme33.
Aprovado desde 1997 pelo FDA para o tratamento das verrugas anogenitais externas, imiquimode a 5% vem acondicionado em sachês. Cada sachê contém creme em quantidade suficiente para cobrir até 20 cm2 de pele lesada. Aplicar camada fina de imiquimode tópico a 5% sobre a área afetada três vezes por semana, antes de dormir, friccionando até que o produto desapareça completamente. Não ocluir o local de aplicação. Deixar o produto agir por seis a dez horas. Após esse período, remover o produto da área tratada lavando-a com água e sabonete suave. Aplicar em dias alternados. Lavar as mãos antes e depois da aplicação do produto. A técnica apropriada para administração da dose deve ser demonstrada pelo médico. O tratamento com imiquimode deve continuar até que haja total remissão dos condilomas acuminados anogenitais externos ou por até 16 semanas no máximo. Para aumentar a absorção em lesões queratinizadas pode-se orientar o paciente para tomar banhos prolongados e aplicar logo após a secagem do local.
Apesar das reações locais como eritema, prurido, descamação e edema serem freqüentes (50%), a queixa de dor local e incidência de reações sistêmicas (sintomas flu-like, cefaléia, coriza e mialgia) é muito baixa (< 3%). Acredita-se que estas reações, na maioria de intensidade leve a moderada e bem toleradas pelos pacientes, estejam ligadas à liberação de citocinas pró-inflamatórias que fazem parte do mecanismo de ação do imiquimode. Assim, o grau de intensidade do eritema e reação local da pele relaciona-se com a resposta clínica, geralmente desaparecendo dentro de duas semanas após suspensão do medicamento.
Na experiência do setor de Patologia do Trato Genital Inferior e Colposcopia do HC-FMUSP, as reações iniciam-se na maioria dos casos após duas semanas de tratamento e atingem um pico em quatro semanas, quando se inicia a regressão das verrugas. A regressão completa das lesões ocorre, em média, no período de oito a dez semanas. Geralmente as lesões localizadas na semimucosa (região vestibular) respondem mais precocemente em quatro a seis semanas. Em casos de condilomatoses extensas, a resposta é mais rápida e quase sempre acompanhada de reação adversa de maior intensidade. Em caso de reações locais mais intensas, pode-se suspender o tratamento por uma a duas semanas até melhora dos sintomas locais, e reiniciar logo em seguida. Observa-se nas pacientes com lesões concomitantes em vagina e cérvice e tratadas com imiquimode por lesões em vulva, resposta à distância com regressão parcial ou total da doença em vagina e cérvice além da resposta local na vulva.
O creme de imiquimode tópico a 5% pode ser usado como terapia de primeira opção (pacientes virgens de tratamento), terapia de segunda opção (paciente com múltiplas recidivas após terapia citodestrutiva) e como terapia combinada (associação de método citodestrutivo à imunoterapia). Independente da modalidade terapêutica escolhida, deve-se assegurar ao paciente que condilomas acuminados externos raramente se tornam malignos. Os médicos devem estar preparados para orientar os pacientes acerca de vários assuntos da esfera psicossexual relacionados à infecção pelo HPV.
Já se tem associado a vacina quadrivalente para o hpv durante esse tratatamento , visto que seria uma garantia de memória imunológica para os hpvs 06/11/16/18 , os mais comuns , implicando em haver menos recidiva mesmo quando a paciente é exposta novamente ao vírus.